Lungenprotektive Beatmung
Allgemeines
Falls eine künstliche Beatmung nötig ist, ist das Ziel immer der selbsttriggernde spontan atmende Patient (meist Pressure Support Ventilation PSV). Schon wenige Stunden einer vollständigen Zwerchfellentlastung durch mechanische Ventilation ohne Eigenatmung führen zu einer Schädigung des Zwerchfells mit Atrophie (NEJM 2008). Nur in Ausnahmefällen (tiefe Sedierung nötig, kein Atemantrieb vorhanden wegen ZNS-Schädigung, schweres ARDS) sollte eine längerfristige (>24h) vollständig kontrollierte Beatmung durchgeführt werden.
Beatmung und Atemmechanik
Eine Beatmung mit hohen Tidalvolumina oder hohen transpulmonalen Beatmungsdrücken führt zur Schädigung der kollagenen Lungengerüstfasern (Ventilator-induzierte Lungenschädigung (VILI)). Es gilt grundsätzlich:
- An die Lungengröße angepasste Tidalvolumina (VT/FRC) reduzieren die Überdehnung (Strain)
- Als Surrogatparameter für die Größe der Lungen wird das Ideale Körpergewicht verwendet
- Beatmung mit niedrigen transpulmonalen Drücken reduziert das Barotrauma (Stress)
- Als Surrogatparameter für Lungenstress wird der Plateaudruck (pPlat) verwendet
- PEEP verhindert Ventilationsinhomogenitäten mit lokaler Lungenschädigung (Atelekttrauma)
(6)-8ml/Kg Idealkörpergewicht beatmet werden. Ausnahmen können bei schwerer COPD und Asthma bestehen.Atemmodus
BIPAP/ASB
Druck-kontrollierte Beatmung mit Möglichkeit der Spontanatmung während des gesamten Atemzyklus. ASB-Druckunterstützung ist auf dem PEEP-Niveau möglich. Innerhalb des Erwartungsfensters werden mandatorische und spontane Atemzüge synchronisiert. Insbesondere bei hohen Atemfrequenzen kommt es zu Asynchronitäten mit zum Teil exzessiv hohen Tidalvolumina (Brochard ICM). Ob diese Asynchronitäten Einfluss auf die Mortalität haben, ist derzeit unklar.
CPAP/ASB
ASB-druckunterstützte Spontanatmung auf PEEP-Niveau.
PEEP
Allgemeines
Der bei der Beatmung anwendbare positive endexpiratorische Druck (PEEP) führt zu einem
dauerhaft positiven Druck während des gesamten Atemzyklus. Durch die Anwendung von
PEEP kann der endexpiratorischen De-Rekrutierung abhängiger Lungenbereiche
entgegengewirkt werden. Dabei ist zu beachten, dass die Einstellung von PEEP selbst nicht zu einer Rekrutierung minderbelüfteter Alveolen führt: Rekrutierung ist ein endinspiratorisches Phänomen – PEEP wird endexpiratorisch wirksam! Insgesamt liegen
nur wenige wegweisende Erkenntnisse aus randomisierten Studien zur PEEP Titration vor.
PEEP beim lungengesunden Intensivpatienten
Im randomisierten RELAX-Trial zeigte sich erwartungsgemäß kein Mortalitätsunterscheid zwischen einer Niedrig-PEEP Gruppe (0-5mmHg) und einer Gruppe mit höheren PEEP (8mmHg). In der Niedrig-PEEP Gruppe traten jedoch mehr schwere Hypoxämien auf und es wurden mehr Rekrutierungsmanöver durchgeführt.
PEEP bei ARDS
Die heterogene Ventilationsverteilung mit einem dorsoventralen Gradienten ist pathognomonisch für die ARDS erkrankte Lunge. Durch die Anwendung von PEEP soll die dorsal nicht- bzw. minderventilierte Lunge belüftet werden und so die Oxygenierung verbessert und die Lungenschädigung durch Verminderung zyklischer Derekrutierung verhindert werden Verschiedene Studien mit unterschiedlicher PEEP Einstellungsstrategien, wie PEEP-FiO2 Tabelle (Alveoli, LOV), Plateaudruck (Express) oder Ösophagusdruck (EPvent2) ergaben keinen Vorteil der getesteten PEEP Strategien. Die meisten Autoren befürworten derzeit eine individuelle PEEP Einstellung, wobei die genaue Strategie nach wie vor unklar erscheint. Insbesondere problematisch ist die heterogene Ventilationsverteilung im ARDS. Sie führt dazu, dass hohe PEEP Werte neben einer Verminderung der Derekrutierung einiger Lungenbereiche häufig untrennbar zur Überblähung von anderen Lungenarealen führen. Suter schlug in seiner Arbeit zum besten PEEP die Titration anhand der besten O2-Versorgung des Gewebes bzw. der Compliance vor. Neuere Studien zeigen, dass die verschiedenen PEEP Strategien (beste Compliance, beste O2-Versorgung, Beste Rekrutierung/wenig Überblähung mittels EIT) im gleichen Patienten zu unterschiedlichen PEEP Werten führen. Im ART-Trial führte ein Rekrutierungsmanöver mit hohen Beatmungsdrücken mit abschließender Einstellung des PEEP anhand der besten Compliance zu einer erhöhten Mortalität. Zusammenfassend scheinen höhere PEEP Werte (10-15 mmHg) im moderaten/schweren ARDS sinnvoll. Die Verwendung sehr hoher PEEP- Werte > 15mmHg sollte Ausnahmen vorbehalten bleiben. Der PEEP kann aus unserer Sicht nicht alleine nach der besten Oxygenierung eingestellt werden, da auch eine PEEP induzierte Verschlechterung der Hämodynamik zu einer Verbesserung der Oxygenierung führt (über eine Verminderung des HZV abhängigen Rechts-Links-Shunts)
ARDS
Allgemeines
Bei Patienten mit schwerem ARDS ist in der Frühphase meist eine kontrollierte Beatmung notwendig. Eine lungenprotektive druckunterstützte Spontanatmung gelingt bei hohem Atemantrieb häufig nicht. Wir verwenden in der Regel BIPAP, da hierbei Spontanatmung des Patienten möglich ist. Hierbei muss aber besonders auf die Einhaltung protektiver Tidalvolumina geachtet werden. Insbesondere im angloamerikanischen Sprachraum wird häufig eine Volumen-kontrollierte Beatmung verwendet (um das Tidalvolumen besser kontrollieren zu können). Es gibt keinen Hinweis auf einen Vorteil eines bestimmten Atemmodus.
Tidalvolumen
Grundsätzlich sollte eine Beatmung mit niedrigen Tidalvolumina von 6-(8) ml/kgKG idealem
Körpergewicht durchgeführt werden. Bei hohem Driving Pressure (> 15cmH2O) sollte die Verwendung kleinerer Tidalvolumina (4-6 ml/KgKG) erwogen werden.
Standard-KG (Frau) = 45.5 + 0.91 (Größe [cm] - 152.4)
Standard-KG (Mann) = 50.0 + 0.91 (Größe [cm] – 152.4)
Insbesondere bei der Anwendung von BIPAP kann die zusätzliche Verwendung von ASB intermittierend zu exzessiv hohen Atemzugvolumina führen. Daher muss bei der Verwendung von BIPAP/ASB die regelmäßige Evaluation der Atemmechanik besonders kritisch erfolgen.
Hyperkapnie
Zur Vermeidung einer Ventilator-induzierten Lungenschädigung kann eine Hyperkapnie akzeptiert werden (permissive Hyperkapnie). Bei klinisch relevanter Hyperkapnie (Rechtsherzdysfunktion/ pH < 7,15-7,2) sollte der anatomische Totraum verkleinert (Iso/Anaconda abbauen, Feuchtbeatmung einbauen) und ggf. das Tidalvolumen erhöht werden.
PEEP, Plateaudruck und Driving Pressure
Es sollte ein höherer PEEP zwischen 10 und 15 cmH2O (20) unter Beachtung der Atem- und Hämodynamik angewendet werden (HZV-Monitoring/TTE). Eine Verbesserung der Oxygenierung durch PEEP-Erhöhung lässt nicht automatisch auf eine bessere pulmonale Ventilation schließen. Auch eine PEEP-induzierte Senkung des Herzzeitvolumens führt durch Reduktion des Rechts-Links-Shunts zu einer Oxygenierungsverbesserung. PEEP-Titration daher immer nach Compliance, pO2, pCO2 und Hämodynamik (SvO2 und TTE). Der gemessene Plateaudruck (inspiratorische Pause) sollte < 30 cmH2O (Ausnahme: erhöhter intraabdomineller Druck), der Driving Pressure (pPlat – PEEP) sollte kleiner < 15 cmH2O betragen, der transpulmonale Driving Pressure sollte 10-12cmH2O nicht überschreiten.
Rekrutierungsmanöver
Auf Rekrutierungsmanöver sollte unserer Ansicht nach - vor dem Hintergrund der aktuellen Datenlage - in der Regel verzichtet werden (ART Trial-erhöhte Mortalität, Pharlap Trial-abgebrochen kein Benefit). Bei kritischer Hypoxie kann ein Rekrutierungsmanöver im Einzelfall indiziert sein.
Spontanatmung
5 Säulen der Lungen- und Zwerchfellprotektiven Beatmung
(Lungen- und Zwerchfellprotektiven Beatmung)
- Anstreben kontinuierlicher Patienten-getriggerter Beatmung CAVE in ARDS- Frühphase
- Monitoring des Atemantriebes
- P0.1
- Pocc
- Pes (falls verfügba)
- Monitoring von Stress und Strain
- Vt/C < 15mbar
- PL (falls verfügbar)
- Ist die Beatmung adequat?
- pH
- pO2
- pCO2
- Weaning-bereitschaft prüfen
Beatmungsparameter
PEEP
Die PEEP-Einstellung erfolgt nach den üblichen Kriterien (Compliance, Hämodynamik, Oxygenierung). Bei hoher Resistance mit intrinsischem PEEP (COPD) sollte der extern applizierte PEEP ca. 2/3 des gemessenen intrinsischen PEEPs betragen.
Pressure Support
Die Höhe des Unterstützungsdruckes muss nach Atemfrequenz, P0.1, Pocc und Tidalvolumen angepasst werden. Die Höhe des PSV hat Einfluss auf Asynchronien und muss diesbezüglich angepasst werden.
Expiratorische Triggersensitivität (ETS)
Die ETS muss der Lungenmechanik angepasst werden. Bei steifer Lunge/niedriger Compliance (kurze expiratorischen Zeitkonstante Rcexp) ist eine kurze ETS nötig (5-25%). Dies führt zu einer längeren Inspiration, die Exspiration ist kurz. Bei COPD mit langer respiratorischer Zeitkonstante ist eine lange Expirationszeit notwendig (ETS 40-70%). Am Hamilton C6/T1 kann die ETS nach der expiratorischen Zeitkonstante eingestellt werden.
Sicherheitsparameter Spontanatmung
Durch hohen Atemantrieb (z.B schweres ARDS) kann es bei Spontanatmung möglicherweise zu einer Lungen- und Zwerchfellschädigung kommen. Genaue Grenzwerte sind dabei derzeit aus randomisierten Studien nicht bekannt. Beachtet werden muss, dass der wahre Plateaudruck und der Driving Pressure bei Spontanatmung nicht direkt am Beatmungsgerät ersichtlich sind und diese dezidiert bestimmt werden müssen (Siehe Atemmechanik)
| Tidalvolumen (expiratorisch gemessen!) | 4-8ml/kgKG |
| Driving pressure | 15mbar |
| P0.1 | 1-4mbar |
| Pocc | 8-20mbar |
Asynchronitäten
Asynchronitäten zwischen Patient und Ventilator verlängern die Beatmungsdauer und erhöhen die Mortalität. Grundsätzlich sollte das Beatmungsgerät an den Patienten, nicht der Patient an das Beatmungsgerät angepasst werden.
Die folgende Systematik ist nicht abschließend, sondern konzentriert sich auf Ursachen häufiger Asynchronitäten. Die Sortierung folgt dem Zeitpunkt des Auftretens im Atemzyklus. Die Definitionen überschneiden sich teils.
| Häufige Ursachen | |
|---|---|
| Trigger-Asynchronie | |
| Auto-Triggering Trigger-Auslösung eines Ventilator-Atemzyklus ohne Atemanstrengung des Patienten, weil der Trigger zu empfindlich eingestellt ist | Reduzierter Atemantrieb, Flüssigkeit/Sekret im Beatmungsschlauch, Leckagen (Cuff, Fistel, Beatmungsschlauch), kardiale Oszillationen |
| Verzögertes Triggern Verzögerung zwischen Inspirationsbemühung des Patienten und Anstieg des insp. Flusses | Altes Beatmungsgerät, reduzierter Atemantrieb (Sedierung, Schlaf, hoher Unterstützungsbedarf, Hypokapnie) |
| Ineffektive Atemanstrengung Atemanstrengung des Patienten mit detektierbarem Atemwegsdruckabfall und zeitgleich reduziertem exspiratorischem Fluss ohne Auslösung eines patienten-getriggerten Atemzyklus | Reduzierter Atemantrieb, zu hoch eingestellter Trigger, Vernebelung in das Beatmungssystem (generiert zusätzlichen Fluss im Beatmungssystem) |
| Intrinsischer PEEP PEEP durch inkomplette Exspiration und konsekutiv Akkumulation von Ausatemluft | Obstruktive Lungenerkrankung, Sekret pulmonal oder in Tubus, kurze Exspirationszeit/ hohe Atemfrequenz |
| Flow-Asynchronie | |
| Unzureichender Ventilator-Flow Relativ zum Atemantrieb nicht ausreichende Flussunterstützung | Gesteigerter Atemantrieb, altes Beatmungsgerät, hoher metabolischer Umsatz (Verbrennung, Sepsis, Fieber), Beatmung mit geringen Tidalvolumina, Agitation |
| Unzureichenden Driving Pressure Relativ zum Atemantrieb nicht ausreichender Unterstützungsdruck (Kamelhöcker in der inspiratorischen Flusskurve) | |
| Unzureichender Druck-/ Flussanstieg Relativ zum Atemantrieb zu lange Zeit des Ventilators bis zum Ziel-Druck/-Fluss | |
| Zyklische Asynchronie | |
| Vorzeitiger Inspirations-Abbruch Tatsächliche Inspirationszeit beträgt weniger als 50% der durchschnittlichen Inspirationszeit, obwohl der Patient eine längere Inspiration benötigt | Restriktive Lungenerkrankung, Husten, zu hoch eingestellter insp. Flow (zu kurze Rampe), zu hohe Druckunterstützung, zu hoch eingestellte ETS (Exspiratory Time Sensitivity; Hamilton; Standard 25%) |
| Verzögerter Inspirations-Abbruch Atemzyklus des Ventilators ist länger als Inspirationszeit des Patienten, und eine aktive Exspiration tritt ein während der unterstützten Inspiration | Obstruktive Lungenerkrankung, Husten, Seufzer, Agitation |
| Exspiratorische Asynchronie | |
| Verzögerte exspiratorische Muskelrelaxation vor Beginn einer folgenden Ventilator-unterstützten Inspiration | Obstruktive Lungenerkrankung, Husten, Seufzer, Agitation, hoher metabolischer Umsatz (Verbrennung, Sepsis, Fieber), hohes Tidalvolumen (unvollständige Exspiration) |
Asynchronitäten zwischen Patient und Ventilator verlängern die Beatmungsdauer und erhöhen die Mortalität. Grundsätzlich sollte das Beatmungsgerät an den Patienten, nicht der Patient an das Beatmungsgerät angepasst werden.
Flow Asynchronitäten
| Flow Asynchronitäten | |
|---|---|
| Verzögertes Triggern Verzögerung zwischen Inspirationsbemühung des Patienten und Anstieg des inspiratorischen Flusses. Häufige Ursache ist ein reduzierter Atemantrieb durch Sedierung, reduzierte Muskelkraft, Hypokapnie oder während des Schlafs. | 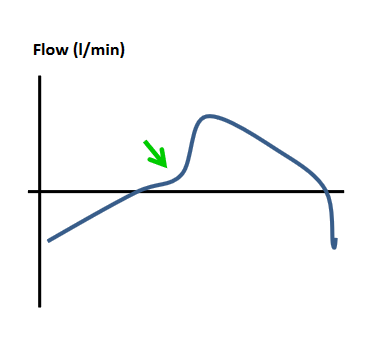 |
| Ineffektives Triggern Eine Inspirationsbemühung des Patienten wird vom Beatmungsgerät nicht erkannt und in der Folge nicht unterstützt. Ursachen können sein ein zu unempfindlich eingestellter Flow-Trigger, ein intrinsischer PEEP oder Inspirationsbemühungen außerhalb des Erwartungsintervalls. | 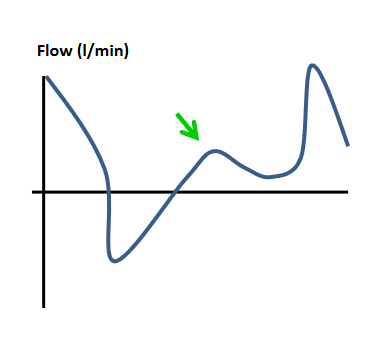 |
| Doppeltes Triggern Mehr als eine Patienten-getriggerte Einatembemühung innerhalb der Hälfte der durchschnittlichen Inspirationszeit. Doppeltes Triggern ist assoziiert mit erhöhtem Atemantrieb und kann zu erhöhten Atemwegsdrücken führen. Seufzer, Husten, unzureichender insp. Flow können Auslöser sein. | 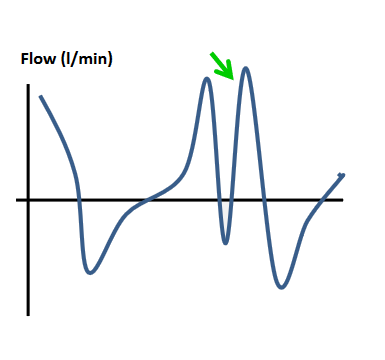 |
| Verzögerte Exspiration Die Inspirationszeit des Patienten endet vor der eingestellten Inspirationszeit des Ventilators; dies führt zu einer kraftraubenden aktiven Exspiration des Patienten. Ursache kann ein zu unempfindlich eingestellter Exspirationstrigger sein. | 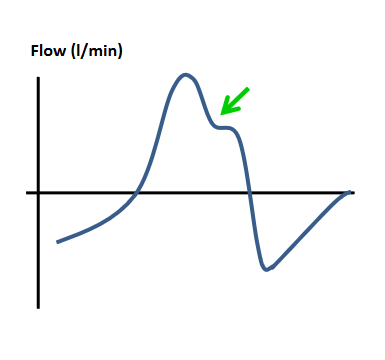 |